Frühe Nutzenbewertung - Pembrolizumab beim Urothelkarzinom
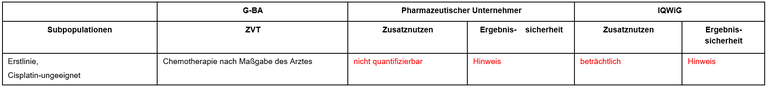
Die frühe Nutzenbewertung von Pembrolizumab in der Erstlinientherapie von Patienten mit fortgeschrittenem/metastasiertem Urothelkarzinom, die nicht für eine Cisplatin-basierte Chemotherapie geeignet sind und einen PD-L1-positiven Tumor mit einem Combined Positive Score (CPS) ≥10 haben, war durch eine Zulassungseinschränkung der EU-Kommission vom 1. Juni 2018 induziert worden. Die Festlegung wurde zeitlich befristet. Jetzt liegen die finalen Daten der Studie KEYNOTE 361 vor. Das IQWiG wurde mit dem Bericht beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen zu identischen Vorschlägen. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1.
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG
Unsere Anmerkungen sind:
- Für diese Neubewertung von Pembrolizumab liegen die Daten der randomisierten, dreiarmigen Phase-III-Studie KEYNOTE 361 vor. Diese vergleicht:
- Chemotherapie + Pembrolizumab
- Pembrolizumab Monotherapie
- Chemotherapie
Gegenstand dieser frühen Nutzenbewertung ist der Vergleich der Pembrolizumab Monotherapie versus Chemotherapie in der Subpopulation der Patien*innen, die für eine Cisplatin-Chemotherapie nicht geeignet gewesen wären und einen PD-L1 positiven (CPS≥10) Tumor hatten. Diese Subpopulation umfasst 119 Patient*innen.
- Pembrolizumab führte gegenüber Chemotherapie nicht zur Reduktion der Mortalität. In den ersten Monaten nach Therapiebeginn sind die Ergebnisse unter Pembrolizumab schlechter als unter Chemotherapie.
- Daten zum koprimären Endpunkt des Progressionsfreien Überlebens und zum sekundären Endpunkt der Objektiven Ansprechrate fehlen im Dossier.
- Die Rate schwerer unerwünschter Ereignisse im CTCAE Grad >3 liegt in dieser Subpopulation von Patient*innen unter Pembrolizumab etwas niedriger als unter Chemotherapie, aber höher als in der Gesamtpopulation der Patient*innen im Pembrolizumab-Arm von KEYNOTE 361. Die Zeit bis zum Auftreten schwerer unerwünschter Ereignisse ist unter Pembrolizumab signifikant verlängert.
- Der IQWiG-Bericht ist unvollständig. Die fehlenden Daten des Dossiers werden nicht thematisiert, auch nicht die Art der Auswertung schwerer Nebenwirkungen. Eine klinische Bewertung der Daten zur Mortalität fehlt.
Pembrolizumab ist eine Option bei Patient*innen mit PD-L1 positiven Tumoren, die nicht für eine Therapie mit Cisplatin geeignet sind. Der Vorteil gegenüber einer Chemotherapie mit Carboplatin/Gemcitabin ist in der Gesamtpopulation nicht belegt. Wesentlich für die individuelle Therapieentscheidung wird neben der zu erwartenden Toxizität auch der Verlauf des fortgeschrittenen/metastasierten Urothelkarzinoms sein.



