Frühe Nutzenbewertung - Niraparib in der Erhaltungstherapie des rezidivierten Ovarialkarzinoms
Niraparib ist zugelassen für die Erhaltungstherapie bei rezidivierten Patientinnen mit gering differenziertem, serösem Karzinom der Ovarien, der Tuben oder mit primärer Peritonealkarzinose, die erneut auf eine platinhaltige Chemotherapie angesprochen haben, d. h. eine komplette oder partielle Remission erreicht haben. Im vorherigen Verfahren (Vorgangsnummer 2019-10-15-D-496) mit Beschlussfassung vom 2. April 2020 war eine Befristung bis zum 1. Februar 2021 beschlossen worden. Das jetzige Verfahren wird nach Ablauf der Befristung durchgeführt. Der G-BA hat das IQWiG mit dem Bericht beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen zu unterschiedlichen Bewertungen. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1.
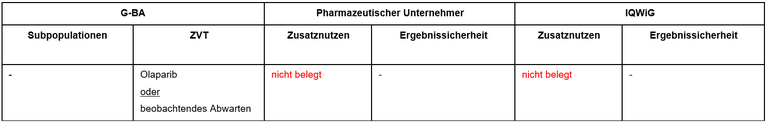
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG
Der von uns im Folgenden verwendete Begriff „Ovarialkarzinom“ umfasst die gesamte Indikation „epitheliales Ovarialkarzinom, Eileiterkarzinom oder primäres Peritonealkarzinom“.
Unsere Anmerkungen sind:
- ZVT bei behandlungsfähigen Patientinnen ist Olaparib.
- Basis der frühen Nutzenbewertung ist NOVA, eine internationale, randomisierte, Placebo-kontrollierte Studie mit einer 2:1 Randomisierung zugunsten des Niraparib-Arms. Zwischenzeitlich liegen auch Daten NORA vor, einer zweiten in China durchgeführten Studie, in der ebenfalls Niraparib versus Placebo randomisiert wurde.
- Niraparib führte in NOVA und in NORA zu einer sehr deutlichen Verlängerung des progressionsfreien Überlebens mit einer Hazard Ratio zwischen 0,27 und 0,45. Darüber hinaus führte Niraparib zu einer deutlichen Verlängerung der TWiST (Time without Toxicity and Symptoms). Das ist vor allem in der Rezidivsituation sehr patientenrelevant.
- Niraparib führte weder in NOVA noch in NORA zur Verlängerung der Gesamtüberlebenszeit, allerdings sind die Daten in NORA noch unreif. Ein möglicher Einfluss der Postprogressionstherapie mit PARP-Inhibitoren im Kontrollarm von NOVA kann aufgrund unvollständiger Dokumentation der Umstellung auf während der Dauer der NOVA Studie zugelassenen PARPi und Abbruch der Teilnahme sowie fehlende Datenerhebung nicht belegt werden. Das Gesamtüberleben war lediglich ein sekundärer Endpunkt von NOVA und NORA.
- Die Rate schwerer Nebenwirkungen in NOVA lag bei 74,1%. Die Mehrzahl schwerer Nebenwirkungen von Niraparib war hämatologisch und trat vor allem in der Anfangsphase der Therapie auf. In NORA lag die Rate schwerer Nebenwirkungen nur bei 50,8%. Dieser Unterschied ist mutmaßlich auf die individualisierte, initial auch niedrigere Dosierung von Niraparib in NORA zurückzuführen.
Mit Niraparib, Olaparib und Rucaparib sind jetzt drei wirksame PARP-Inhibitoren zur Erhaltungstherapie von Patientinnen mit rezidiviertem, epithelialem Ovarialkarzinom, die erneut auf eine platinhaltige Chemotherapie angesprochen haben, zugelassen. Die Wirksamkeit erscheint insgesamt vergleichbar.



