Frühe Nutzenbewertung - Tepotinib beim metastasierten NSCLC mit METex14-Skipping
Dies ist das erste Verfahren zu einem gezielten Arzneimittel beim nichtkleinzelligen Lungenkarzinom (NSCLC) mit METex14-Skipping. Tepotinib (Tepmetko®) ist zugelassen zur Behandlung von Patient*innen mit einem fortgeschrittenen nicht-kleinzelligen Lungenkarzinom (NSCLC) und METex14-Skipping nach systemischer Therapie mit Platin-basierter Chemotherapie und/oder Immuncheckpoint-Inhibitoren. Das IQWiG wurde vom G-BA mit dem Bericht beauftragt. Subgruppen, zweckmäßige Vergleichstherapie sowie Bewertungsvorschläge sind in Tabelle 1 zusammengefasst.
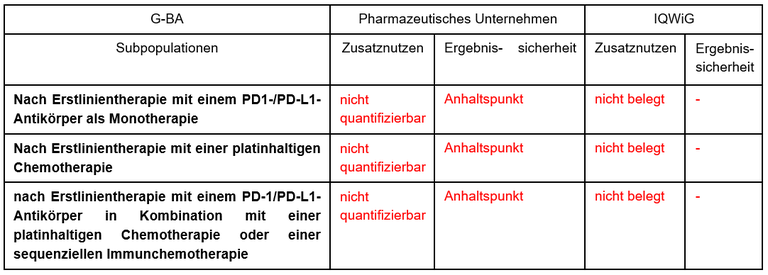
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG
Unsere Anmerkungen sind:
- Die Unterteilung der Subgruppen in der Zweitlinientherapie ist formal korrekt. Klinisch ist allerdings nur die dritte der vom G-BA festgelegten Subpopulationen relevant. Sie entspricht der Versorgung und den aktuellen Therapieempfehlungen. Sie ist gelb unterlegt. Es ist auch fraglich, ob die Effektivität von Tepotinib aufgrund der dominanten Treibermutation von der Vortherapie abhängt.
- Basis der frühen Nutzenbewertung ist VISION, eine offene, internationale, multizentrische Phase-2 Studie.
- Tepotinib führte bei den vorbehandelten Patient*innen zu einer Ansprechrate von 42-45%, einem medianen progressionsfreien Überleben von 7,6 – 7,9 Monaten und einer medianen Gesamtüberlebenszeit von 13,1 Monaten.
- Tepotinib führte zu einer Linderung von krankheitsassoziierten Symptomen (Husten, Thoraxschmerz),
- Die Rate schwerer Nebenwirkungen ist nicht sehr hoch. Das Nebenwirkungsspektrum ist spezifisch. Ein Teil der Nebenwirkungen im Schweregrad 3/4 betrifft erhöhte Laborwerte ohne klinische Symptomatik.
- In der Bewertung des klinischen Nutzens auf der ESMO-Magnitude of Clinical Benefit Scale v1.1 erhält Tepotinib den Grad 3 (Skala 1 (niedrig) – 5 (hoch)).
Tepotinib ist das erste, gezielt wirksame Arzneimittel beim NSCLC mit METex14-Skipping. Die aktuell vorliegenden Daten zeigen Ansprech- und Überlebensraten, die über den Erwartungen liegen. Ein direkter Vergleich mit anderen Therapieoptionen wurde in der Zulassungsstudie nicht vorgenommen. Auch im Dossier wird kein nicht-randomisierter, adjustierter Vergleich z. B. mit Registerdaten vorgenommen. Die Begründung für dieses Vorgehen ist unklar.



