Frühe Nutzenbewertung - Selinexor beim Multiplen Myelom
Diese frühe Nutzenbewertung von Selinexor (Nexpovio®) ist ein weiteres Verfahren zu einem neuen Arzneimittel beim Multiplen Myelom. Selinexor ist in Kombination mit Bortezomib und Dexamethason zugelassen für Patientinnen und Patienten (Pat.) mit Multiplen Myelom, die zuvor mindestens eine Therapie erhalten haben. Das IQWiG wurde mit dem Bericht beauftragt. Subgruppen, zweckmäßige Vergleichstherapie sowie die unterschiedlichen Bewertungsvorschläge sind in Tabelle 1 zusammengefasst.
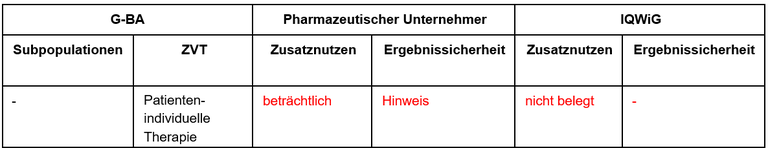
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG
Unsere Anmerkungen sind:
- Selinexor gehört zu einer neuen Substanzklasse. Es blockiert Exportin 1 (XPO1).
- Basis der frühen Nutzenbewertung ist die randomisierte, offene Phase-III-Studie BOSTON zum Vergleich von Selinexor / Bortezomib / Dexamethason versus Bortezomib / Dexamethason. Bortezomib wurde Selinexor-Arm einmal wöchentlich, im Kontrollarm zweimal wöchentlich appliziert. Etwa 70% der Pat. in der Zulassungsstudie hatten eine Bortezomib-Vortherapie.
- Selinexor führte gegenüber dem Kontrollarm zur statistisch signifikanten Verlängerung des progressionsfreien Überlebens (Median 3,78 Monate; HR 0,71) und zur Erhöhung mindestens partieller Remissionen. Die Gesamtüberlebenszeit wurde nicht verlängert.
- Häufigste Nebenwirkungen im Selinexor-Arm waren Thrombozytopenie und Fatigue. Die Rate belastender Neuropathien war im Selinexor-Arm signifikant niedriger. Die Erhebungszeitpunkte der Neuropathie waren in den beiden Studienarmen nicht identisch.
- Die allgemeine Lebensqualität war in beiden Studienarmen nicht unterschiedlich.
Selinexor ist eine weitere Option bei Pat. mit rezidiviertem/refraktärem MM. Der Zusatznutzen im aktuellen Versorgungskontext ist angesichts der Verfügbarkeit einer Vielzahl weiterer, hochwirksamer Therapieoptionen beim rezidivierten/refraktären MM und dem Fehlen direkt vergleichender Daten zwischen diesen Innovationen nicht quantifizierbar. Bei der Bewertung der neurologischen Nebenwirkungen ist die niedrigere Dosierung von Bortezomib im Selinexor-Arm und die Verfügbarkeit von alternativen Proteasom-Inhibitoren in der Versorgung zu berücksichtigen.



