Frühe Nutzenbewertung - Nivolumab / Ipilimumab beim malignen Pleuramesotheliom
Die frühe Nutzenbewertung von Nivolumab/Ipilimumab ist das erste Verfahren für ein neues Arzneimittel beim malignen Pleuramesotheliom. Nivolumab ist in Kombination mit Ipilimumab für die Erstlinientherapie des nicht resezierbaren, malignen Pleuramesotheliom zugelassen. Der G-BA hat keine Subgruppen/Subpopulationen gebildet. Das IQWiG wurde mit dem Bericht beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen zu unterschiedlichen Bewertungen. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1.
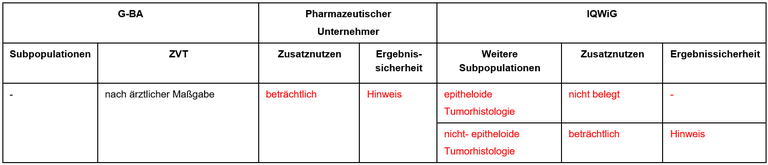
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG
Unsere Anmerkungen sind:
- Als zweckmäßige Vergleichstherapie wurde vom G-BA eine Therapie nach ärztlicher Maßgabe festgelegt. Standard bei Patient*innen in gutem Allgemeinzustand und ohne spezifische Kontraindikationen ist:
- platinhaltige Chemotherapie + Pemetrexed
- Basis der frühen Nutzenbewertung von Nivolumab/Ipilimumab beim nicht-resezierbaren Pleuramesotheliom ist die internationale, offene, randomisierte Studie CA209-743 (CheckMate 743) zum Vergleich einer Immuntherapie mit Nivolumab/Ipilimumab versus einer Chemotherapie mit Platinderivaten und Pemetrexed.
- Nivolumab/Ipilimumab führte gegenüber der Chemotherapie zur Verlängerung der Gesamtüberlebenszeit (HR 0,74; Median 4 Monate) und zur Steigerung der Überlebensrate nach 3 Jahren.
- Nivolumab/Ipilimumab führte nicht zur Steigerung der Ansprechrate und nicht zur Verlängerung des progressionsfreien Überlebens.
- Nivolumab/Ipilimumab führte bei Parametern des Gesundheitszustands zur signifikanten Symptomverbesserung gegenüber Chemotherapie.
- Die Rate schwerwiegender, therapieassoziierter, unerwünschter Ereignisse im CTCAE Grad ≥3 war in beiden Therapie-Armen gleich hoch. Die spezifischen Nebenwirkungen der beiden, sehr verschiedenen Studienarme entsprechen denen einer kombinierten Immun- bzw. Chemotherapie.
- Der Vorschlag aus dem IQWiG-Bericht für eine weitere Subgruppenbildung auf der Basis der Histologie mit „epitheloid“ versus „nicht-epitheliod“ ist sehr problematisch. Diese Differenzierung ist an Biopsien nicht immer möglich, an Zytologien nahezu ausgeschlossen.
- In der Bewertung des klinischen Nutzens auf der ESMO-Magnitude of Clinical Benefit Scale v1.1 erhält Nivolumab/Ipilimumab den Grad 3 (Skala 1 (niedrig) – 5 (hoch)).
Mit Nivolumab/Ipilimumab steht jetzt erstmals seit fast 20 Jahren eine wirksame Alternative zur Platin- und Pemetrexed-haltigen Chemotherapie beim nicht-resezierbaren Pleuramesotheliom zur Verfügung.



