Frühe Nutzenbewertung - Loncastuximab Tesirin bei aggressiven B-Zell-Lymphomen
Diese frühe Nutzenbewertung von Loncastuximab Tesirin (Zynlonta®) ist ein weiteres Verfahren zur Therapie aggressiver B-Zell-Lymphome. Loncastuximab Tesirin ist zugelassen zur Behandlung des rezidivierten oder refraktären diffusen großzelligen B-Zell-Lymphoms (DLBCL) und des High-Grade B-Zell-Lymphoms (HGBL) nach zwei oder mehr systemischen Behandlungslinien. Der G-BA hat zwei Subpopulationen gebildet. Das IQWiG wurde mit der Dossierbewertung beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen zu unterschiedlichen Bewertungen. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1.
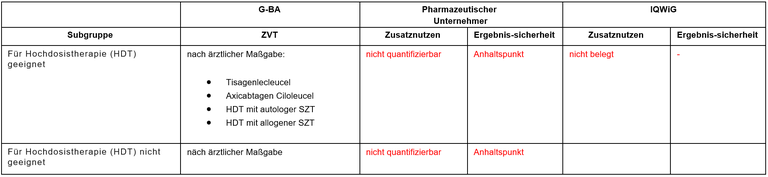
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG
pU – pharmazeutischer Unternehmer; ZVT – zweckmäßige Vergleichstherapie;
Unsere Anmerkungen sind:
- Die Einteilung in diese beiden Subgruppen ist nach Einführung der neueren Arzneimittel nicht mehr nachvollziehbar. Wichtigere Kriterien sind Ansprechen und Verträglichkeit bei den vorherigen Therapien. Korrekt ist die Therapie nach ärztlicher Maßgabe. Bei der Konkretisierung der zu berücksichtigenden Therapieformen durch den G-BA werden allerdings Kombinationen aufgeführt, die in dieser Form nicht evidenzbasiert sind und auch nicht in Leitlinien empfohlen werden.
- Loncastuximab Tesirin ist ein neues Antikörper-Drug-Konjugat. Basis der frühen Nutzenbewertung ist LOTIS-2, eine einarmige, multizentrische Phase-II Studie mit 145 Pat.
- Loncastuximab Tesirin führte bei 48,3% der Pat. zu einer Remission. Die 3-Jahresüberlebensrate lag bei 28,6%.
- Die Rate schwerer unerwünschter Ereignisse im CTCAE-Grad 3/4 lag bei 56%. Am häufigsten tragen Zytopenien und immunvermittelte Nebenwirkungen auf.
- Loncastuximab Tesirin wird als Monotherapie und nicht in Kombination mit anderen, antineoplastisch wirksamen Arzneimitteln gegeben.
Loncastuximab Tesirin ist ein weiteres, hochwirksames Arzneimittel beim r/r DLBCL. Der Zusatznutzen ist auf der Basis einer Phase-II-Studie nicht quantifizierbar.




