Frühe Nutzenbewertung - Brentuximab Vedotin beim sALCL
Dieses Verfahren zum Einsatz von Brentuximab Vedotin (Adcetris®) in der Erstlinientherapie von Patient*innen mit systemischem, anaplastischem großzelligem Lymphom (sALCL) in Kombination mit Doxorubicin, Cyclophosphamid und Prednison (CHP) wird nach Ablauf der im ersten Verfahren gesetzten Frist durchgeführt. Brentuximab Vedotin hat den Status eines Medikamentes zur Behandlung einer seltenen Erkrankung (Orphan Drug). Der Bericht wurde vom G-BA erstellt. Subgruppen, zweckmäßige Vergleichstherapie sowie Bewertungsvorschläge sind in Tabelle 1 zusammengefasst.
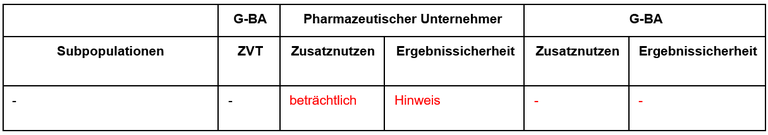
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG
Unsere Anmerkungen sind:
- Für die Beurteilung des Zusatznutzens liegen weiterhin die Daten der multizentrischen, randomisierten, offenen Studie ECHELON-2 zum Vergleich von Cyclosphosphamid / Doxorubicin / Prednison + Brentuximab Vedotin (CHP+BV) gegenüber Cyclosphosphamid / Doxorubicin / Prednison + Vincristin (CHOP) vor. Entsprechend der Zulassung wurden für die frühe Nutzenbewertung die Daten aus ECHELON-2 für die Patient*innen mit ALCL ALK+ und einem IPI Score >2 sowie Patient*innen mit ALCL ALK- ausgewertet.
- Basis des jetzt vorgelegten Dossiers des pharmazeutischen Unternehmers ist der finale Datenschnitt vom 5. November 2020. Die Daten sind in Tabelle 2 zusammengefasst.
Tabelle 2: Brentuximab Vedotin in der Erstlinientherapie des ALCL

- CHP+BV führte gegenüber CHOP zu einer Steigerung der Rate kompletter Remissionen, zur Verlängerung des progressionsfreien Überlebens und zur Steigerung der Überlebensrate nach 3 Jahren. Für die Steigerung der Überlebensrate ergibt sich beim finalen Datenschnitt ein Wert von p=0,0530. Das ereignisfreie Überleben wird durch CHP+BV signifikant gegenüber CHOP verlängert (HR 0,63; p=0,0034).
- Die auf dem Jahreskongress der European Society of Hematology (EHA) im Juli 2021 präsentierten 5-Jahres-Daten bestätigen die Nachhaltigkeit der Ergebnisse [2].
- Die Rate schwerer Nebenwirkungen war in den beiden Studienarmen fast gleich hoch.
- Bei der Erfassung der Lebensqualität und des Patient-Reported Outcome zeigten sich keine signifikanten Unterschiede zwischen den beiden Behandlungsgruppen.



