Frühe Nutzenbewertung - Atezolizumab Monotherapie beim nicht kleinzelligen Lungenkarzinom
Die frühe Nutzenbewertung von Atezolizumab ist ein weiteres Verfahren zur Erstlinientherapie beim fortgeschrittenen nichtkleinzelligen Lungenkarzinom (NSCLC). Atezolizumab ist als Monotherapie zugelassen zur Therapie von Patient*innen mit metastasiertem, nicht-kleinzelligem Lungenkarzinom (NSCLC) und einer hohen PD-L1-Expression, definiert als Tumor Proportion Score [TPS] von ≥50% (Tumorzellanteil) oder ≥10 % tumorinfiltrierenden Immunzellen (IC, Tumorflächenanteil). Die PD-L1 Expression wurde mittels des Ventana PD-L1 (SP142) Assays bestimmt. Ausgeschlossen sind Patient*innen mit EGFR-Mutationen oder ALK-Fusionen. Der G-BA hat zwei Subgruppen zur Festlegung der zweckmäßigen Vergleichstherapie gebildet und das IQWiG mit dem Bericht beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen zu unterschiedlichen Bewertungen. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1.
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG
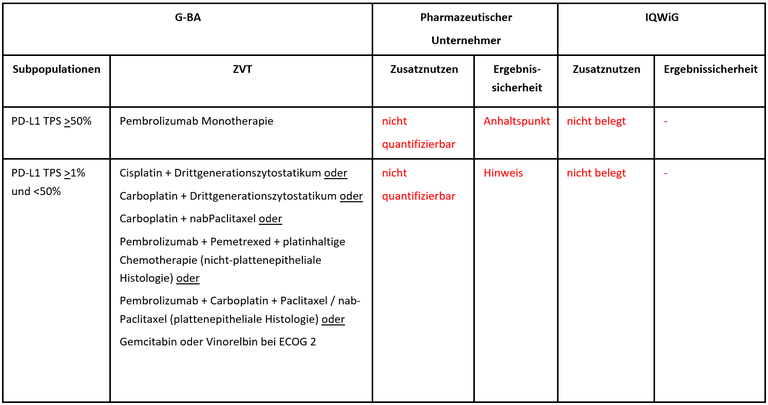
Unsere Anmerkungen sind:
- Eine besondere Herausforderung dieses Verfahrens liegt in den unterschiedlichen Methoden zur Definition einer hohen PD-L1-Expression in den verschiedenen Zulassungsstudien für Immuncheckpoint-Inhibitoren. Das betrifft sowohl die eingesetzten Testverfahren als auch die Zielzellen (Tumorzellen, Immunzellen). Die Assays führen zu unterschiedlichen Ergebnissen.
- Bei Patient*innen mit einem fortgeschrittenen/metastasierten NSCLC, hoher PD-L1 Expression der Tumorzellen und fehlender Indikation für eine molekular gezielte Therapie bestehen zwei Therapieoptionen:
- Immuntherapie: Monotherapie mit einem Immuncheckpoint-Inhibitor (ICI)
- Immunchemotherapie: Kombination von Immuncheckpoint-Inhibitoren mit einer platinhaltigen Chemotherapie.
- Bei Patient*innen mit einem fortgeschrittenen/metastasierten NSCLC, hoher PD-L1 Expression der tumorinfiltrierenden Immunzellen und fehlender Indikation für eine molekular gezielte Therapie besteht die Therapieoption:
- Immunchemotherapie: Kombination von Immuncheckpoint-Inhibitoren mit einer platinhaltigen Chemotherapie oder
Nur bei Kontraindikationen gegenüber einer Immuncheckpoint-Inhibitor-Therapie, die insgesamt selten vorliegt, kommt noch eine alleinige platinhaltige Kombination in Betracht.
- Immunchemotherapie: Kombination von Immuncheckpoint-Inhibitoren mit einer platinhaltigen Chemotherapie oder
- Entsprechend sehen wir die ZVT folgendermaßen:
- PD-L1 TPS >50% (TC): Immuncheckpoint-Inhibitor - Monotherapie (Pembrolizumab, Cemiplimab) oder Immunchemotherapie (Immuncheckpoint-Inhibitor(en) + platinhaltige Chemotherapie)
- PD-L1 >10% (IC): Immunchemotherapie (Immuncheckpoint-Inhibitor(en) + platinhaltige Chemotherapie)
- Die weitere Subgruppenbildung des G-BA in diesem Verfahren der frühen Nutzenbewertung ist nicht korrekt. Patient*innen mit einer hohen Expression von PD-L1 auf Immunzellen (IC3) überlappen nur teilweise mit den Patient*innen mit einer hohen Expression von PD-L1 auf Tumorzellen (TC3). Die Definition der PD-L1-Expression TPS >1% und <50% ist kein angemessenes Surrogat für das in der Zulassungsstudie verwendete Einschlusskriterium einer PD-L1-Expression >10% auf Immunzellen. Ebenfalls wurden in den Zulassungsstudien für Pembrolizumab und für Atezolizumab unterschiedliche Assays für die PD-L1 Expressionsmessung verwendet, die nicht analog gesetzt werden können.
- Basis der frühen Nutzenbewertung ist IMpower110, eine internationale, randomisierte, offene Phase-III-Studie zum Vergleich von Atezolizumab gegenüber einer platinhaltigen Chemotherapie. Der ursprünglich in der Studie getestete Biomarker des „Tumor Mutational Burden“ hatte sich nicht als prädiktiv erwiesen.
- Atezolizumab führte gegenüber einer platinhaltigen Chemotherapie zur Steigerung der Remissionsrate, zur Verlängerung der progressionsfreien Überlebenszeit und zur Verlängerung der Gesamtüberlebenszeit.
- Atezolizumab führte auch zur Reduktion der Rate schwerer Nebenwirkungen und zur Verlängerung der Zeit bis zur Verschlechterung des Gesundheitszustandes.
- In der Bewertung des klinischen Nutzens auf der ESMO-Magnitude of Clinical Benefit Scale v1.1 erhält Atezolizumab gegenüber platinhaltiger Chemotherapie den Grad 5 (Skala 1 (niedrig) – 5 (hoch)).
- In den aktuellen Leitlinien und in der Versorgung beschränkt sich die Empfehlung zur gezielten Therapie bei Nachweis prädiktiver genetischer Aberrationen nicht nur auf EGFR-Aberrationen und ALK-Translokationen.
Die Atezolizumab-Monotherapie ist eine weitere Option in der Erstlinientherapie des lokal fortgeschrittenen oder metastasierten NSCLC mit hoher PD-L1 Expression. Im Vergleich mit anderen Immuncheckpoint-Inhibitoren erscheint die Wirksamkeit von Atezolizumab vergleichbar, die Nebenwirkungsrate möglicherweise günstiger. metastasierten NSCLC mit hoher PD-L1 Expression. Im Vergleich mit anderen Immuncheckpoint-Inhibitoren erscheint die Wirksamkeit von Atezolizumab vergleichbar, die Nebenwirkungsrate möglicherweise günstiger. Für die Gruppe der Patient*innen mit weniger als 50% PD-L1-exprimierender Tumorzellen aber mehr als 10% tumorinfiltrierender Immunzellen ist die Therapie mit Atezolizumab die einzige verfügbare Option einer Monoimmuntherapie.



