Hodgkin-Lymphome (Stand Februar 2012)
Erstellung der Leitlinie
Stand: Februar 2012
1First Department of Internal Medicine, University Hospital Cologne, Cologne, Germany;
2Zentrum für Innere Medizin, Stiftungsklinikum Mittelrhein gGmbH, Koblenz, Germany;
3German Hodgkin Study Group (GHSG)
Definition und Basisinformationen
Das Hodgkin-Lymphom ist eine maligne Erkrankung des lymphatischen Systems. Die neoplastischen Zellen lassen sich in der überwiegenden Zahl der Fälle von B Lymphozyten ableiten. Charakteristisch ist eine geringe Zahl von malignen Hodgkin-Reed-Sternberg (H RS) Zellen, die von zahlreichen reaktiven Zellen (Bystander Cells) umgeben sind. Die Inzidenz beträgt 2-3/100.000 pro Jahr, wobei der Altersgipfel bei ca. 32 Jahren liegt.
Die häufigsten Primärlokalisationen sind zervikal (60-80%), mediastinal und inguinal. Die Ausbreitung des Hodgkin-Lymphoms erfolgt sowohl lymphogen oder per continuitatem in lymphatische Organe als auch hämatogen oder per continuitatem in extralymphatische Organe.
Klassifikation
Die Klassifikation des Hodgkin Lymphoms erfolgt nach der WHO-Klassifikation:
I. Lymphozytenprädominantes Hodgkin Lymphom (NLPHL; Synonyme: LPHD, noduläres Paragranulom)
Das NLPHL macht etwa 5% aller Hodgkin Lymphome aus. Die malignen Zellen werden im Unterschied zum klassischen Hodgkin Lymphom L&H (lymphocytic and histiocytic) genannt und tragen meist die B Zell-Antigene CD20 und CD79a
II. klassisches Hodgkin Lymphom (cHL)
Nodulär-sklerosierender Typ (NS)
Mischtyp (MC)
Lymphozytenreicher Typ (LR)
Lymphozytenarmer Typ (LD)
Nicht-klassifizierbar.
Die Tumorzellen des klassischen Hodgkin-Lymphoms werden als Hodgkin- und Reed-Sternberg-Zellen (H-RS) bezeichnet und tragen typischerweise die Antigene CD30 und CD15. Die histologische Subklassifikation innerhalb der Diagnose cHL hat bisher keine therapeutischen Konsequenzen.
Durch eine stadienadaptierte Therapie können heute über 80% aller Patienten langfristig geheilt werden. Damit ist das Hodgkin-Lymphom eine der am besten behandelbaren onkologischen Erkrankungen im Erwachsenenalter.
Klinisches Bild
Patienten stellen sich häufig mit länger andauernden, z. T. undulierenden, Lymphknotenschwellungen vor, die in den meisten Fällen schmerzlos sind. Fieber (u. U. in Form des Pel-Ebstein-Fiebers), Nachtschweiß, Gewichtsabnahme oder Pruritus können als begleitende Symptome auftreten. Der in der Literatur z. T. als charakteristisch beschriebene Alkoholschmerz tritt nur selten (ca. 5%) auf.
Laborveränderungen wie z. B. BSG- oder CRP-Erhöhung, Leukozytose, Eosinophilie oder Lymphopenie sind uncharakteristisch. Es gibt keinen für das Hodgkin-Lymphom spezifischen Laborparameter, der zur Diagnostik oder Verlaufkontrolle herangezogen werden kann.
Diagnostik
Die histologische Diagnose erfolgt durch eine Lymphknotenbiopsie, wobei wenn möglich ein ganzer Lymphknoten entnommen werden sollte. Eine Feinnadelaspiration (Zytologie) ist aufgrund des geringen Anteils an H RS Zellen und der nicht-beurteilbaren Lymphknotenstruktur nicht ausreichend. Da die Diagnosestellung für den Pathologen sehr schwierig sein kann, sollte eine Beurteilung durch einen Referenzpathologen angestrebt werden. Bei initialer Beurteilung als „reaktive Veränderung“ und klinischer Progredienz sollte eine erneute Biopsie durchgeführt werden.
Da die Therapie des Hodgkin-Lymphoms streng stadienabhängig erfolgt, ist eine präzise Festlegung des initialen Stadiums (Staging) unbedingt erforderlich.
Hierzu gehören:
Anamnese (B Symptome: Fieber, Nachtschweiß (mit Wechsel der Wäsche), ungewollter Gewichtsverlust (<10% des KG in 6 Monaten)
Körperliche Untersuchung (tastbare Lymphknoten, Hepatosplenomegalie)
Zellzählung mit Differentialblutbild
BSG
LDH, GOP, GPT, AP, gamma-GT, Harnsäure, Kreatinin
Röntgen-Thorax
CT Hals, Thorax, Abdomen (mit Kontrastmittel)
Knochenmarkbiopsie (Zytologie und Histologie)
Die Durchführung einer Leberbiopsie ist nur bei Verdacht auf einen diffusen Leberbefall (z. B. unklare AP-Erhöhung) angezeigt, sofern ein solcher die Therapiewahl beeinflussen würde. Finden sich im Rahmen der Staging-Untersuchungen fokale Läsionen in der Leber (CT und/oder Ultraschall), ist ein Befall zu unterstellen.
Die explorative Laparotomie mit Splenektomie wird nicht mehr empfohlen [II, A].
Die routinemäßige Durchführung einer Positonen-Emissions-Tomographie (PET) im Rahmen des initialen Stagings wird nicht empfohlen, da es bisher keine Daten für ein verbessertes Outcome gibt. Sie kann jedoch bei in der CT grenzwertig vergrößerten Lymphknoten erwogen werden, sofern ein Befall die Therapieauswahl beeinflussen würde. Hierbei ist zu bedenken, dass auch entzündlich veränderte Lymphknoten (häufige Differential-diagnose) in der PET mit einem erhöhten FDG-Uptake einhergehen können, so dass eine histologische Klärung häufig dennoch erforderlich ist.
Um Patienten mit einem erhöhten Risiko für Akut- und/oder Spätkomplikationen identifizieren zu können, sind Untersuchungen der Lungenfunktion und des Herzens (EKG, Herz-Echo) vor Therapiebeginn obligat.
Da die meisten Therapieansätze mit dem Risiko einer dauerhaften Infertilität einhergehen, sollte insbesondere bei jüngeren Patientinnen und Patienten eine Vorstellung bei einem Reproduktionsmediziner erfolgen.
Stadieneinteilung
Die Stadieneinteilung erfolgt in Stadium I bis IV nach der modifizierten Ann-Arbor-Klassifikation
Stadium I | Nodaler Befall in einer einzigen Region (I,N) oder Vorliegen eines einzigen lokalisierten extranodalen Herdes (I,E) |
Stadium II | Nodaler Befall (II,N) und/oder lokalisierte extranodale Herde (II,E) in zwei oder mehreren Regionen auf einer Seite des Zwerchfells |
Stadium III | Nodaler Befall (III,N) und/oder lokalisierte extranodale Herde (III,E) auf beiden Seiten des Zwerchfells |
Stadium IV | Disseminierter Befall einer oder mehrerer extralymphatischer Organe mit oder ohne Befall von Lymphknoten |
Lymphatisches Gewebe: Lymphknoten, Milz, Thymus, Waldeyer’scher Rachenring.
B-Symptome:
nicht anderweitig erklärbares Fieber über 38°C;
nicht anderweitig erklärbarer Nachtschweiß (Wechsel der Nachtwäsche);
nicht anderweitig erklärbarer Gewichtsverlust von mehr als 10% des Körpergewichtes innerhalb von 6 Monaten.
Risikogruppen („Stadien“)
Eine Zusammenfassung in Gruppen nach Lymphomausbreitung und Risikofaktoren wird von allen internationalen Studiengruppen durchgeführt [II-III, A].
Die europäischen Studiengruppen (GHSG, EORTC, GELA) haben sich in ihrer Risikostratifizierung jedoch in den letzten Jahren deutlich angenähert, so dass hier mittlerweile nur noch geringe Unterschiede bestehen. Die Deutsche Hodgkin Studiengruppe (GHSG) verwendet die folgende Einteilung, welche sich in der Praxis bewährt hat.
Riskofaktoren (gemäß GHSG)
Befall von 3 oder mehr Lymphknotenarealen (s. Abbildung1)
hohe BSG (in der ersten Stunde; ≥50mm mit B-Symptomen, ≥30mm ohne B Symptome)
großer Mediastinaltumor (≥1/3 des maximalen Thoraxquerdurchmessers in der konventionellen Röntgenaufnahme des Thorax)
E-Befall
Differentialdiagnose
Als Differentialdiagnose kommen alle entzündlich bedingten Lymphknotenvergrößerungen bakterieller oder viraler Genese (z.B. Tuberkulose, Toxoplasmose, Epstein-Barr-Virus, Zytomegalievirus, HIV) in Betracht. Des Weiteren sind andere maligne Lymphome, Lymphknotenmetastasen solider Tumoren, Thymome, Keimzelltumoren oder eine Sarkoidose in die differentialdiagnostischen Erwägungen einzubeziehen und ggf. auszuschließen.
Therapie
Patienten mit Hodgkin Lymphom sollten wenn immer möglich im Rahmen von klinischen Studien behandelt werden.
Die Therapie sollte unmittelbar nach der Diagnose und der Stadienfestlegung beginnen. Da die Therapieintention bei Erstdiagnose fast immer kurativ ist, sollte eine Dosisreduktion nur bei harter Indikation erfolgen. Lediglich bei extrem komorbiden Patienten kann eine primär palliative Therapiestrategie erwogen werden.
Als Spätfolgen der Chemo- und Strahlentherapie werden u.a. Infertilität, Hypothyreose und koronare Herzerkrankung beobachtet. Darüber hinaus ist das Risiko für Sekundärmalignome (AML/MDS, NHL, solide Tumoren) erhöht. Dieses Risiko bleibt lebenslang bestehen und ist abhängig von der kumulativen Dosis und Auswahl der verabreichten Zytostatika sowie von Dosis und Feldgröße der Strahlentherapie.
Therapie für frühe Stadien
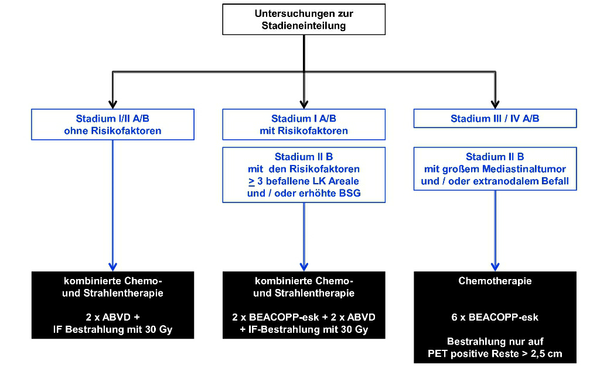
Standardtherapie für frühe Stadien ist eine Kombinationstherapie bestehend aus einer kurzen Chemotherapie gefolgt von einer Involved-Field-Radiotherapie (IF-RT). Diese Kombination ist sowohl einer alleinigen Strahlentherapie als auch einer alleinigen Chemotherapie hinsichtlich der Tumorkontrolle überlegen. Standard für die Chemotherapie sind 2 Zyklen des ABVD Regimes (s. Tab. 2). Als Standard für die Dosis der Strahlentherapie gelten 30Gy [I, A].
Derzeit wird der Stellenwert einzelner Zytostatika des ABVD Regimes im Rahmen einer klinischen Studie der GHSG geprüft. Zwei der vier Therapiearme (ABV und AV) wurden jedoch aufgrund einer erhöhten Ereignisrate vorzeitig geschlossen.
Zur Frage, ob eine weitere Reduktion der Strahlentherapiedosis auf 20Gy zu einer ausreichenden Tumorkontrolle führt, liegen derzeit noch keine Daten mit ausreichend langer Nachbeobachtung vor.
Die Frage, ob für einzelne Patienten die Strahlentherapie entbehrlich ist, wird derzeit in klinischen Studien untersucht (HD16-Studie der GHSG).
Adriamycin | 25 | mg/m2 | i.v. | Tag 1 + 15 |
Bleomycin | 10 | mg/m2 | i.v. | Tag 1 + 15 |
Vinblastin | 6 | mg/m2 | i.v. | Tag 1 + 15 |
Dacarbazin | 375 | mg/m2 | i.v. | Tag 1 + 15 |
Wiederholung: Tag 29
Therapie für intermediäre Stadien
Standardtherapie für intermediäre Stadien ist eine Kombinationstherapie bestehend aus einer Chemotherapie gefolgt von einer Involved-Field-Radiotherapie (IF-RT). Der weitestgehend akzeptierte Standard besteht aus 4 Zyklen ABVD gefolgt von 30Gy IF-RT [I, A].
Jedoch zeigte eine kürzliche Zwischenauswertung der HD14-Studie der GHSG eine Verbesserung der Tumorkontrolle (PFS nach 3 Jahren) von 90% auf 96% unter Verwendung von 2 Zyklen BEACOPPeskaliert (s. Tab. 3) gefolgt von 2 Zyklen ABVD und 30Gy IF-RT. Auf Basis dieser Ergebnisse wurde der Standardarm der Studie geschlossen. Die derzeit laufenden Untersuchungen zur Fertilität sollten vor einer endgültigen Bewertung dieser Kombination abgewartet werden.
Zur Frage, ob eine weitere Reduktion der Strahlentherapiedosis auf 20Gy zu einer ausreichenden Tumorkontrolle führt, liegen derzeit noch keine Daten mit ausreichend langer Nachbeobachtung vor.
Die Frage, ob die zu bestrahlenden Felder weiter verkleinert werden können (Involved-Node RT), wird derzeit in klinischen Studien (HD17 Studie der GHSG) untersucht.
Therapie für fortgeschrittene Stadien
Standard für fortgeschrittene Stadien ist eine alleinige Chemotherapie. Standard für die Chemotherapie sind 6 Zyklen BEACOPPeskaliert (s. Tab. 3) [I, A]. Es zeigt gegenüber ABVD eine deutliche Verbesserung hinsichtlich der Tumorkontrolle und des Gesamtüberlebens.
Im Rahmen der HD15-Studie der GHSG wurde gezeigt, dass eine Therapie mit 6 Zyklen BEACOPPeskaliert weniger toxisch und effektiver ist als der bisherige Standard von 8 Zyklen BEACOPPeskaliert (FFTF 89,3% vs. 84,4%; OS 95,3% vs. 91,9%).
Ebenfalls im Rahmen der HD15-Studie der GHSG wurde geprüft, ob die Bestrahlung auf die Patienten beschränkt werden kann, die nach Ende der Chemotherapie noch PET-positive Restlymphome von ≥ 2,5cm hatten. Es zeigte sich, dass die Patienten mit PET-negativen Restlymphomen ≥ 2,5cm auch ohne ergänzende Bestrahlung eine vergleichbare Prognose wie die Patienten hatten, bei denen nach Ende der Chemotherapie eine CR/CRr vorlag. Der negative prädiktive Wert (NPV) der PET liegt in dieser Situation bei 94%.
Patienten mit PET-positiven residuellen Lymphomen sollen eine lokale Bestrahlung mit 30Gy erhalten. Aufgrund der guten Prognose dieser Patienten (PFS nach 4 Jahren 86,2%) ist eine Intensivierung der Therapie z.B. mittels einer Hochdosistherapie nicht gerechtfertigt.
Bleomycin | 10 | mg/m2 | i.v. | Tag 8 |
Etoposid | 200 | mg/m2 | i.v. | Tag 1-3 |
Adriamycin | 35 | mg/m2 | i.v. | Tag 1 |
Cyclophosphamid | 1250 | mg/m2 | i.v. | Tag 1 |
Vincristin | 1,4 | mg/m2 | i.v. | Tag 8 |
Procarbazin | 100 | mg/m2 | p.o. | Tag 1-7 |
Prednison | 40 | mg/m2 | p.o. | Tag 1-14 |
G-CSF | s.c. | Ab Tag 8 |
Therapie für Patienten >60 Jahre
Patienten, die älter als 60 Jahre sind, sollten aufgrund der erhöhten Toxizität nicht mit BEACOPPeskaliert behandelt werden. Es wird empfohlen, diese Patienten stadienadaptiert mit 2, 4 bzw. 6-8 Zyklen ABVD zu behandeln [I-II, A]. Die Empfehlungen zur Strahlentherapie gelten analog den Empfehlungen für jüngere Patienten.
Therapie des NLPHL
Die Prognose für Patienten mit lokalisiertem Stadium (Stadium IA) ohne Risikofaktoren ist hervorragend. Für diese Patienten ist eine alleinige Strahlentherapie mit 30Gy im IF ausreichend [III, A]. Patienten mit ausgedehnterem Befall sollten stadienadaptiert analog den Therapieempfehlungen für das cHL behandelt werden. Für Patienten mit Rezidiv eines NLPHL kommt neben den Empfehlungen für das cHL aufgrund der CD20 Expression auch der Einsatz eines anti-CD20 Antikörpers [Off-Label Use] in Betracht [III, B].
Therapie im Rezidiv
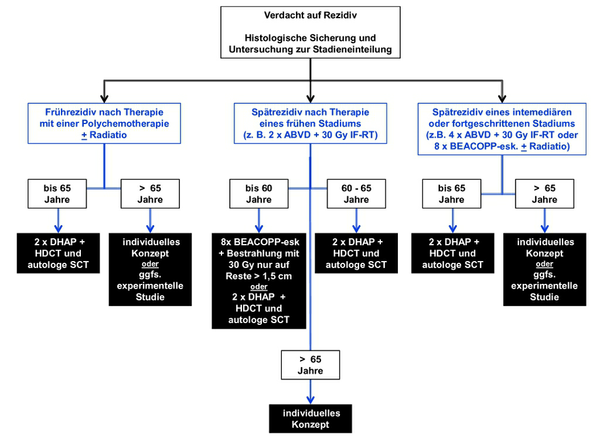
Generell wird zwischen Patienten mit einem Frührezidiv (3-12 Monate nach Ende der Primärtherapie) und solchen mit einem Spätrezidiv (>12 Monate nach Ende der Primärtherapie) unterschieden. Patienten mit einen Frührezidiv haben eine schlechtere Prognose als Patienten mit einem Spätrezidv. Für die meisten Patienten im 1. Rezidiv stellt eine Reinduktionstherapie gefolgt von einer Hochdosischemotherapie mit anschließender autologer Stammzelltransplantation die Therapie der Wahl dar [I, A].
Diese ist der alleinigen konventionellen Chemotherapie hinsichtlich des rezidiv freien Überlebens überlegen. Zur Reinduktion und Stammzellmobilisierung können Chemotherapieregime wie DHAP oder IGEV zum Einsatz kommen. Andere Chemotherapieregime sind hinsichtlich ihrer Effektivität schlechter untersucht. In der kürzlich veröffentlichten Endauswertung der HD-R2 Studie der GHSG wurden 2 Zyklen DHAP gefolgt von HDCT/APBSCT als Standard definiert. Eine weitere Therapieintensivierung vor der HDCT führte dabei nicht zu einer Verbesserung der Ergebnisse.
Für eine kleine Untergruppe (Primärtherapie mit 2 Zyklen ABVD plus IF-RT, Spätrezidiv) kann eine intensive konventionelle Chemotherapie mit z. B. 8 Zyklen BEACOPPeskaliert in Betracht kommen [IV, B].
Eine alleinige Strahlentherapie kann bei Patienten mit lokalisiertem Rezidiv in Betracht kommen [IV, B]. Für Patienten mit einem Rezidiv nach einer APBSCT ist kein Standard definiert. Die Auswahl der Therapie sollte den Gesamtzustand des Patienten sowie die bisherigen Therapien und vorliegende Begleiterkrankungen berücksichtigen.
Die allogene Stammzelltransplantation ist kein Standard für Patienten mit einem Rezidiv nach APBSCT. Sie kann jedoch bei jungen Chemotherapie-sensiblen Patienten in gutem Allgemeinzustand in Erwägung gezogen werden [II-III, B] und sollte vorzugsweise im Rahmen von klinischen Studien durchgeführt werden. Durch die Einführung der RIC-allo (reduced intensity conditioning allogeneic stem cell transplantation) konnte die transplantationsassoziierte Mortalität deutlich gesenkt werden, jedoch sind die weiterhin hohen Rezidivraten unbefriedigend.
Für Patienten mit einem Spätrezidiv nach APBSCT kann eine weitere Hochdosischemotherapie gefolgt von einer APBSCT in Erwägung gezogen werden [IV, B]. In palliativer Therapieintention werden lokale Strahlentherapie, Monotherapien mit Gemcitabine [Off-Label Use], Vinblastin, Vinorelbin [Off-Label Use], niedrigdosiertem Etoposid alleine oder in Kombination mit Steroiden eingesetzt. Aktuell werden z. B. monoklonale Antikörper, Immuntoxine, Histon-Deacetylase-Inhibitoren (HDAC) oder Immunmodulatoren (z.B. Lenalidomid) im Rahmen von Phase I/II Studien auf Ihre Wirksamkeit hin untersucht.
Verlaufskontrolle
Eine Verlaufskontrolle / Kontrolle des Ansprechens sollte nach der Hälfte der Chemotherapie und nach Ende aller Therapiemaßnahmen erfolgen. In frühen Stadien sollte die Verlaufskontrolle nach 2 Zyklen Chemotherapie erfolgen. Eine körperliche Untersuchung, die Bestimmung von Laborwerten und CT-Untersuchungen sind hierbei obligat. Ziel ist es, diejenigen Patienten zu identifizieren, die nicht auf die Chemotherapie angesprochen haben.
Obwohl für die FDG-PET im Rahmen von Studien bei Patienten mit fortgeschrittenen Stadien gezeigt wurde, dass Patienten mit geringem Rezidivrisiko identifiziert werden können, sollte eine Stratifizierung der Therapie auf Basis einer solchen PET zunächst weiterhin auf klinische Studien beschränkt bleiben. Nach Ende aller Therapiemaßnahmen kann ein pathologisch erhöhter FDG-Uptake in der PET persistierende Lympomherde anzeigen, jedoch müssen falsch positive Ergebnisse (z. B. Folgen der Radiotherapie, Entzündung) ausgeschlossen werden. In Zweifelsfällen ist eine histologische Sicherung anzustreben.
Nachsorge
Neben der Entdeckung eines Rezidivs dient die Nachsorge auch zur Feststellung von Spättoxizitäten oder Sekundärmalignomen. Im ersten halben Jahr sollten die Nachsorgeuntersuchungen alle 3 Monate, bis zum 5. Jahr alle 6 Monate und später jährlich erfolgen. Im Rahmen der Nachsorge sollte eine körperliche Untersuchung und Laborwertbestimmungen (Zellzählung mit Differentialblutbild, BSG, klinische Chemie) erfolgen. Darüber hinaus sollte die Schilddrüsenfunktion, insbesondere nach einer Bestrahlung der Halsregion, regelmäßig überwacht werden (1, 2 und 5 Jahre nach Therapie). Eine Bildgebung mittels CT sollte einmalig ca. 3 Monate nach Ende der Therapie für alle Patienten durchgeführt werden, die nicht in kompletter Remission sind (CRu, PR, SD). Weitere CTs sollten bei klinischem Verdacht eines Rezidives erfolgen. Die gezielte Befragung der Patienten nach Spätschäden, insbesondere von Herz und Lunge, ist zu empfehlen. Insbesondere sollten Patienten auf eine Nikotinkarenz hingewiesen werden, da sich die Risiken des Rauchens und der Spättoxizitäten der Chemo-Radiotherapie überadditiv summieren. Auch Patienten mit Fettstoffwechselstörungen sollten engmaschig überwacht werden, da ihr kardiovaskuläres Risiko deutlich erhöht ist.
Die Patienten sollten regelmäßig an den angebotenen Krebsfrüherkennungsprogrammen teilnehmen.
Der Stellenwert der PET in der Nachsorge ist derzeit nicht klar und wird daher nicht empfohlen. Meist werden Rezidive durch die Patienten selbst bemerkt. Zur Diagnosestellung eines Rezidives ist eine histologische Sicherung anzustreben.
Algorithmus zum praktischen Vorgehen
Literatur
Engert A, Franklin J, Eich HT et al.Two cycles of doxorubicin, bleomycin, vinblastine, and dacarbazine plus extended-field radiotherapy is superior to radiotherapy alone in early favorable Hodgkin's lymphoma: final results of the GHSG HD7 trial. J Clin Oncol 2007; 25: 3495-3502.
Ferme C, Eghbali H, Meerwaldt JH et al.Chemotherapy plus involved-field radiation in early-stage Hodgkin's disease. N Engl J Med 2007; 357: 1916-1927.
Engert 2010: Borchmann P, Engert A, Pluetschow A et al. Dose-Intensified Combined Modality Treatment with 2 cycles of BEACOPPescalated followed by 2 cycles of ABVD and Involved Field Radiotherapy (IF-RT)is superior to 4 cycles of ABVD and IF-RT in patients with early unfavourable Hodgkin Lymphoma (HL): An analysis of the German Hodgkin Study Group (GHSG) HD14 trial. Blood (ASH Annual Meeting Abstracts) 2008; 112: abstract 367.http://abstracts.hematologylibrary.org/cgi/content/abstract/116/21/765?maxtoshow=&hits=10&RESULTFORMAT=1&author1=Borchmann+P&title=HD14&andorexacttitle=and&andorexacttitleabs=and&andorexactfulltext=and&searchid=1&FIRSTINDEX=0&sortspec=relevance&fdate=11/1/2008&resourcetype=HWCIT
Canellos GP, Niedzwiecki D. Long-term follow-up of Hodgkin's disease trial.N Engl J Med 2002; 346: 1417-1418.
Diehl V, Franklin J, Pfreundschuh M et al.Standard and increased-dose BEACOPP chemotherapy compared with COPP-ABVD for advanced Hodgkin's disease. N Engl J Med 2003; 348: 2386-2395.
Schmitz N, Pfistner B, Sextro M et al.Aggressive conventional chemotherapy compared with high-dose chemotherapy with autologous haemopoietic stem-cell transplantation for relapsed chemosensitive Hodgkin's disease: a randomised trial. Lancet 2002; 359: 2065-2071.
Josting A, Rudolph C, Reiser M et al. Time-intensified dexamethasone /cisplatin/cytarabine: an effective salvage therapy with low toxicity in patients with relapsed and refractory Hodgkin's disease. Ann Oncol 2002; 13: 1628-1635.
Santoro A, Magagnoli M, Spina M et al. Ifosfamide, gemcitabine, and vinorelbine: a new induction regimen for refractory and relapsed Hodgkin's lymphoma. Haematologica 2007; 92: 35-41
Sieniawski M, Franklin J, Nogova L et al.Outcome of patients experiencing progression or relapse after primary treatment with two cycles of chemotherapy and radiotherapy for early-stage favorable Hodgkin's lymphoma. J Clin Oncol 2007; 25: 2000-2005.
Josting A, Nogova L, Franklin J et al. Salvage radiotherapy in patients with relapsed and refractory Hodgkin's lymphoma: a retrospective analysis from the German Hodgkin Lymphoma Study Group. J Clin Oncol 2005; 23: 1522-1529.
Sureda A, Robinson S, Canals C et al. Reduced-intensity conditioning compared with conventional allogeneic stem-cell transplantation in relapsed or refractory Hodgkin's lymphoma: an analysis from the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol 2008; 26: 455-462.
Smith SM, van Besien K, Carreras J et al. Second autologous stem cell transplantation for relapsed lymphoma after a prior autologous transplant.Biol Blood Marrow Transplant 2008; 14: 904-912.
Schulz H, Rehwald U, Morschhauser F et al.Rituximab in relapsed lymphocyte-predominant Hodgkin lymphoma: long-term results of a phase 2 trial by the German Hodgkin Lymphoma Study Group (GHSG). Blood 2008; 111: 109-111.
Hutchings M, Loft A, Hansen M et al. FDG-PET after two cycles of chemotherapy predicts treatment failure and progression-free survival in Hodgkin lymphoma. Blood 2006; 107: 52-59.
Gallamini A, Hutchings M, Rigacci L et al. Early interim 2-[18F]fluoro-2-deoxy-D-glucose positron emission tomography is prognostically superior to international prognostic score in advanced-stage Hodgkin's lymphoma: a report from a joint Italian-Danish study.J Clin Oncol 2007; 25: 3746-3752.
Kobe C, Dietlein M, Franklin J et al.Positron emission tomography has a high negative predictive value for progression or early relapse for patients with residual disease after first-line chemotherapy in advanced-stage Hodgkin lymphoma. Blood 2008; 112: 3989-3994.
Cheson BD, Pfistner B, Juweid ME et al. Revised response criteria for malignant lymphoma. J Clin Oncol 2007; 25: 579-586.
Anschriften der Verfasser
First Department of Internal Medicine
University Hospital Cologne
Kerpener Str. 62
50924 Köln
Tel.: 0221 / 478-5933
Fax: 0221 / 478-3778
a.engert@uni-koeln.de
Download
Reference:
Quellenangabe:
Onkopedia-Leitlinien werden kontinuierlich an den Stand des Wissens angepasst. Die jeweils gültige Version, AGB und Nutzungsbedingungen finden Sie unter www.onkopedia.com.
Für die kommerzielle Nutzung wenden Sie sich bitte an onkopedia@dgho.de.
Onkopedia guidelines are continuously adapted to the state of knowledge. The currently valid version, terms of use and general terms and conditions can be found at onkopedia-guidelines.info.
For commercial use, please contact onkopedia@dgho.de.




