Heranwachsende und junge Erwachsene (AYA, Adolescents and Young Adults)
Erstellung der Leitlinie
Stand: September 2012
1 Definition und Basisinformation
Die Betreuung von Heranwachsenden und jungen Erwachsenen (Adolescents and Young Adults (AYA)) mit Krebs stellt eine besondere Herausforderung an die ärztliche und pflegerische Kompetenz dar [15]. Die medizinischen und psychosozialen Bedürfnisse in dieser Altersgruppe unterscheiden sich wesentlich von Kindern einerseits und älteren Menschen andererseits. Die Prognose der krebserkrankten Heranwachsenden und jungen Erwachsenen ist überdurchschnittlich gut, mehr als 80 % werden langfristig geheilt. Zur weiteren Erhöhung der Zahl langfristig geheilter Patienten ist neben neuen Therapiestrategien auch eine Optimierung der Versorgung erforderlich [8, 36, 37].
Die Altersdefinition ist in der medizinischen Fachliteratur nicht einheitlich. Als untere Grenze werden 15 - 18 Jahre, als obere Altersgrenze 28 - 39 Jahre verwandt. Die Gruppe der Heranwachsenden und jungen Erwachsenen ist sehr heterogen. Gemeinsame Merkmale sind die hohe Heilungschance, die Notwendigkeit zur Auseinandersetzung mit Krebs in einer altersbedingt komplexen, psychosozialen Situation, und die Angst vor Langzeitfolgen und Zweiterkrankungen.
2 Epidemiologie
Krebs ist eine Erkrankung des älteren Menschen. Bei Heranwachsenden und jungen Erwachsenen sind Krebserkrankungen relativ selten. Pro Jahr werden in Deutschland etwa 4.500 Patienten im Alter zwischen 15 und 39 Jahren neu diagnostiziert, bei insgesamt 450.000 Neuerkrankungen [13]. In dieser Altersgruppe sind Männer etwas häufiger, in der Altersspanne zwischen 30 und 40 Jahren sind Frauen häufiger betroffen, s. Abbildung 1.
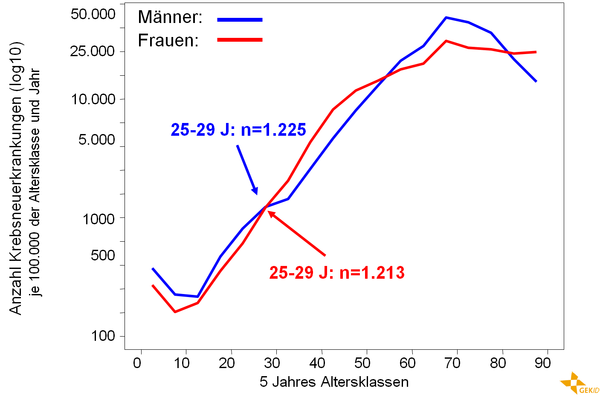
Die epidemiologischen Daten zeigen, dass es graduell über die unterschiedlichen Alterskohorten hinweg zu einem Wandel in der Diagnoseverteilung kommt [13, 16], siehe Tabelle 1 und 2. Bei Frauen zwischen 20 und 30 Jahren ist das maligne Melanom die relativ häufigste Krebserkrankung. In der nächsten Dekade steht bereits das Mammakarzinom an erster Stelle, an dritter Stelle das Zervixkarzinom. Bei Männern zwischen 20 und 35 Jahren macht das Hodenkarzinom fast die Hälfte der malignen Erkrankungen aus.
15 - 19 Jahre | 20 - 24 Jahre | 25 - 29 Jahre | 30 - 34 Jahre | 35 - 39 Jahre | |||||
Diagnose | % | Diagnose | % | Diagnose | % | Diagnose | % | Diagnose | % |
Hodgkin Lymphom | 27 | Melanom | 43 | Melanom | 21 | Mammakarzinom | 32 | Mammakarzinom | 41 |
Schilddrüsenkarzinom | 17 | Hodgkin Lymphom | 11 | Mammakarzinom | 19 | Melanom | 16 | Zervixkarzinom | 13 |
Melanom | 16 | Gehirn / ZNS | 9 | Schilddrüsenkarzinom | 13 | Zervixkarzinom | 14 | Melanom | 11 |
Leukämien | 11 | Schilddrüsenkarzinom | 8 | Zervixkarzinom | 12 | Schilddrüsenkarzinom | 10 | Schilddrüsenkarzinom | 8 |
Gehirn und ZNS | 7 | Leukämien | 8 | Hodgkin Lymphom | 8 | Hodgkin Lymphom | 4 | kolorektales Karzinom | 5 |
andere | 22 | andere | 21 | Andere | 26 | andere | 24 | andere | 22 |
15 - 19 Jahre | 20 - 24 Jahre | 25 - 29 Jahre | 30 - 34 Jahre | 35 - 39 Jahre | |||||
Diagnose | % | Diagnose | % | Diagnose | % | Diagnose | % | Diagnose | % |
Hodentumor | 27 | Hodentumor | 43 | Hodentumor | 48 | Hodentumor | 44 | Hodentumor | 30 |
Hodgkin Lymphom | 17 | Hodgkin Lymphom | 11 | Melanom | 10 | Melanom | 11 | Melanom | 12 |
Leukämien | 16 | Melanom | 9 | Hodgkin Lymphom | 8 | Non-Hodgkin Lymphom | 6 | kolorektales Karzinom | 8 |
Non-Hodgkin Lymphom | 11 | Leukämien | 8 | Non-Hodgkin Lymphom | 6 | Gehirn und ZNS | 6 | Non-Hodgkin Lymphom | 7 |
Gehirn und ZNS | 7 | Non-Hodgkin Lymphom | 8 | Leukämie | 6 | kolorektales Karzinom | 6 | Niere | 5 |
andere | 22 | andere | 21 | Andere | 21 | andere | 27 | andere | 38 |
Die Daten des Tumorregisters München zeigen die überdurchschnittlich gute Prognose der jungen Patienten, siehe Abbildung 2.
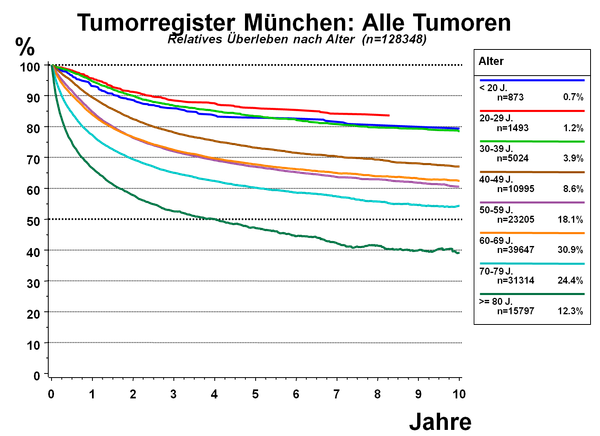
(D. Hölzel und J. Engel, 2011)
3 Primärprävention und Früherkennung
3.1 Primärprävention
Die Empfehlungen zur Primärprävention beziehen sich auf die bisher identifizierten, erworbenen Risikofaktoren:
- nicht rauchen
- Übergewicht vermeiden
- abwechslungsreiche, Gemüse-, Obst- und Ballaststoffreiche Ernährung
- hohe UV Belastung der Haut vermeiden
- HPV Vakzine bei weiblichen Jugendlichen und jungen Frauen vor dem ersten Geschlechtsverkehr; HPV Vakzine ist auch wirksam bei Männern zur Prävention einer HPV Infektion und zur Reduktion der Vorstufen maligner Erkrankungen [14]. Der formale Nachweis eines Einflusses auf die Inzidenz von Malignomen fehlt.
3.2 Früherkennung
Es gibt kein sinnvolles Früherkennungsprogramm für Heranwachsende und junge Erwachsene ohne familiäre Belastung. Anleitungen zur Selbstuntersuchung der Haut, der Brust und der Hoden werden propagiert, sind aber nicht Bestandteil qualitätsgesicherter Gesundheitsprogramme und haben evtl. sogar negative Auswirkungen (hoher Anteil falsch positiver Befund, Auslösung von Angst und Stress). Bei Angehörigen von Familien mit bekannter hereditärer Belastung wird frühzeitig eine genetische Beratung empfohlen. Früherkennungsmaßnahmen sollten spätestens 10 Jahre vor dem Alter der Erstdiagnose der erkrankten Verwandten beginnen.
Bei Heranwachsenden und jungen Erwachsenen mit nachgewiesenen, prädisponierenden Erkrankungen, z. B. chronisch entzündlicher Darmerkrankung, wird die Erstellung eines individuellen Plans für Früherkennungsmaßnahmen empfohlen.
4 Aufklärung
Die Inhalte der Aufklärungsgespräche mit Heranwachsenden und jungen Erwachsenen sind in Tabelle 3 in Form einer Checkliste zusammengefasst.
Inhalt | Checkliste |
Art der malignen Erkrankung und Stadium | |
Therapie | |
Standard | |
Alternativen | |
Studien | |
Festlegung des Therapieplans | |
Prognose | |
Nebenwirkungen | |
akute Nebenwirkungen | |
mittel- und langfristige Nebenwirkungen | |
Fertilität | |
Strategien zur Vermeidung von Nebenwirkungen | |
psychoonkologische Unterstützung | |
soziale Unterstützung | |
Informationsmaterial, weitere Informationsquellen | |
Benennung der Ansprechpartner |
5 Therapiekonzepte
Die Therapie ist bei Heranwachsenden und jungen Erwachsenen nicht prinzipiell anders als bei älteren Patienten. Sie richtet sich nach der histo- bzw. zytologischen Diagnose, nach dem Erkrankungsstadium, biologischen Risikofaktoren und der Komorbidität. Die Verteilung der biologischen Subtypen kann sich von der Verteilung bei älteren Patienten unterscheiden [1, 18, 29]. Informationen über aktuelle Empfehlungen sind in Tabelle 4 und 5 für die häufigeren Erkrankungen aufgeführt.
Tumorentität | Fachgesellschaft / Organisation | Quellen |
ALL - Akute lymphatische Leukämie | Kompetenznetz Leukämie | |
AML - Akute myeloische Leukämie | DGHO Kompetenznetz Leukämie | |
Hodentumore | European Consensus Conference | |
Hodgkin Lymphom | DGHO Kompetenznetz Maligne Lymphome | |
Mammakarzinom | AWMF S3 Leitlinie DGHO | |
Melanom, maligne | AWMF S2 Leitlinie | |
Non-Hodgkin Lymphom, aggressiv | Kompetenznetz Maligne Lymphome | |
Weichteilsarkome | DGHO | |
Zervixkarzinom | AWMF S2 Leitlinie |
Tumorentität | Fachgesellschaft / Organisation | Quellen |
ALL - Akute lymphatische Leukämie | AWMF S1 Leitlinie GPOH | |
AML - Akute myeloische Leukämie | AWMF S1 Leitlinie GPOH | |
Ewing - Sarkom und PNET | AWMF S1 Leitlinie GPOH | |
Hirntumore | AWMF S1 Leitlinie GPOH | |
Hodgkin Lymphom | AWMF S1 Leitlinie GPOH | |
Osteosarkome | AWMF S1 Leitlinie GPOH | |
Non-Hodgkin Lymphom | AWMF S1 Leitlinie GPOH | |
Weichteilsarkome | AWMF S1 Leitlinie GPOH |
Für maligne Erkrankungen, die sowohl bei Kindern / Jugendlichen als auch bei Erwachsenen auftreten, existieren in der Pädiatrie und in der Internistischen Onkologie unterschiedliche Therapieprotokolle. Betroffen sind das Hodgkin Lymphom, die akuten Leukämien, aggressive Non-Hodgkin Lymphome, Sarkome und bestimmte Hirntumore. Die Behandlungskonzepte basieren auf denselben Modalitäten (Operation, Bestrahlung, Chemotherapie, gezielte Therapie, u. a.), unterscheiden sich aber in Dosierungen, Therapiedauer und -intervallen, oder der Indikation zum Einsatz der Stammzelltransplantation.
Im Unterschied zur internationalen Literatur macht es im deutschsprachigen Raum keinen prognostischen Unterschied, ob Heranwachsende nach Protokollen der Pädiatrie oder der internistischen Onkologie behandelt werden, siehe Wissensdatenbank AYA, Wissensdatenbank ALL oder Wissensdatenbank AYA Hodgkin Lymphom.
In den aktuellen pädiatrischen oder adulten Therapieoptimierungsstudien gilt eine Altersgrenze von 18 Jahren. Verfügbares Wissen bezieht sich ganz überwiegend auf Kohorten mit dieser Altersgrenze, die deshalb zur Therapieentscheidung möglichst innerhalb der jeweiligen Protokolle verwendet werden sollte.
Heranwachsende und junge Erwachsene sollen im Rahmen der Therapieoptimierungsstudien der internistischen bzw. der pädiatrischen Hämatologie und Onkologie behandelt werden, siehe Tabellen 4 und 5.
6 Psychosoziale Situation
Die Diagnose einer Krebserkrankung gehört für alle Betroffenen zu den intensivsten Lebenserfahrungen. Bei Heranwachsenden und jungen Erwachsenen kommt sie zu einem Zeitpunkt, an dem Gedanken an eigene Krankheit und Tod weit entfernt sind. Andere Themen stehen im Vordergrund, je nach Stadium der Persönlichkeitsreifung: Unabhängigkeit, Akzeptanz bei Freunden und Partnern, sexuelle Orientierung und Erfahrung, Mobilität, Alkohol- und Drogenkonsum, Lösung vom Elternhaus, Ausbildung, Arbeitsplatz und Karriere, Gründung einer Familie u. a. [25, 27].
In der Konfrontation mit existentiell bedrohlicher Krankheit stagnieren die Prozesse von Ablösung, Identitätsfindung und -orientierung. Fremdbestimmtheit und Abhängigkeit nehmen objektiv und subjektiv wieder zu. Im Vergleich mit älteren Patienten weisen Heranwachsende und jungen Erwachsene größere psychosoziale Defizite auf [2, 3, 24] und sind zusätzlich durch finanzielle Probleme stärker belastet. Auf der anderen Seite neigen sie weniger zur Verleugnung der Krebsdiagnose [35].
Zur qualifizierten Behandlung der Heranwachsenden und jungen Erwachsenen gehören das frühzeitige und langfristige Angebot einer psychoonkologischen Betreuung und die professionelle Unterstützung bei der Bewältigung sozialer, auch beruflicher und finanzieller Probleme.
7 Therapieadhärenz
Therapieadhärenz ist ein besonderes Thema bei der Betreuung von Heranwachsenden und jungen Erwachsenen [10, 28]. Eine labile psychische Situation und belastende soziale Faktoren können die Therapieadhärenz beeinträchtigen und die Prognose verschlechtern [10]. Hierzu gehört auch eine größere Risikobereitschaft mit verzögerter Reaktion auf kritische Nebenwirkungen und großzügiger Interpretation vorgegebener Therapieintervalle [28].
Strategien zur Unterstützung der Therapieadhärenz sind
- klare Informationen
- Vermittlung von Zugang zu weiteren Informationsquellen [19]
- Vermittlung von Kontakten zu Gleichbetroffenen ähnlichen Alters
- gleiche Sprachebene
- Shared Decision Making (partizipative Entscheidungsfindung) ab dem ersten Arzt-Patient-Kontakt
- Schaffen einer Vertrauensbasis
- klare Festlegung der Ansprechpartner
- aktive, verantwortliche Rolle des Patienten
- Förderung der altersadäquaten Entwicklung des Patienten
Nicht hilfreich sind überprotektives, überkontrollierendes Verhalten und eine schematische Behandlung als „Kinder“ oder „unreife Erwachsene“ [25].
8 Langzeitfolgen der Therapie und Zweiterkrankungen
Das erste Ziel der Behandlung ist die Heilung, das zweite Ziel die weitestgehende Vermeidung von Nebenwirkungen, einschl. Langzeitkomplikationen. In diesen Zielen unterscheidet sich die Krebstherapie der jungen nicht von der Krebstherapie der älteren Patienten. Besonders belastend für Heranwachsende und junge Erwachsene sind Störungen der körperlichen Integrität, die Beeinträchtigung der Fertilität und das Risiko von Zweitneoplasien [29].
8.1 Fertilität
Häufige Folgen medikamentöser Tumortherapie können eine Einschränkung der Ovarialfunktion bis zu ovariellem Versagen (POF - Premature Ovarian Failure) bei Frauen und eine Azoospermie bei Männern sein. Auch die Strahlentherapie des kleines Beckens bei Frauen, der Hoden und des Schädels beeinträchtigen die Fertilität. Risikofaktoren für eine permanente Infertilität sind [5, 23]
- Alter zum Zeitpunkt der Therapie
- Art der Therapie: Bestrahlung, Chemotherapie
- Intensität der Therapie und kumulative Dosis
Die Information über das Risiko der Infertilität soll bei Heranwachsenden und jungen Erwachsenen Bestandteil des Aufklärungsgesprächs sein.
8.1.1 Frauen
In Abhängigkeit von den verwendeten Medikamenten bzw. einer Bestrahlung des Beckens kann es unter bzw. kurz nach der Therapie zum akuten Versagen der ovariellen Funktion (Acute Ovarian Failure) kommen oder zum frühzeitigen Eintritt der Menopause (Premature Ovarian Failure) nach einer Zeit der scheinbar ungestörten Ovarialfunktion [12]. Die Menstruationsanamnese ist ein unzuverlässiger klinischer Parameter. Am besten geeignet zur Bestimmung des ovariellen Follikelpools ist die Serumbestimmung des Anti-Müller Hormons (AMH) [31]. Es gibt allerdings keine Möglichkeit, mittels des AMH Wertes oder anderer Serum-Hormonwerte sichere Aussagen zur Fertilität zu machen.
Inzwischen stehen verschiedene fertilitätserhaltende Maßnahmen zur Verfügung [32, 33]. Die Wahl der geeigneten Methode ist abhängig von
- Art der onkologischen Therapie
- Zeitfenster bis zum erforderlichen Beginn der onkologischen Therapie
- Wahrscheinlichkeit für ovarielle Metastasierung
- Partnerstatus
- Alter
- Patientenwunsch
- Kosten
In Deutschland, Österreich und der Schweiz hat sich seit 2006 ein Netzwerk für fertilitätsprotektive Maßnahmen unter Chemo- und Strahlentherapie etabliert [20]. Patientinnen mit prospektivem Kinderwunsch sollen vor Einleitung der onkologischen Therapie einem reproduktionsmedizinischen Zentrum mit Erfahrungen auf diesem Gebiet vorgestellt werden.
8.1.1.1 Ovariopexie
Die Follikel sind hoch strahlensensitiv. Bei einer geplanten Bestrahlung des kleinen Beckens unter Einschluss der Ovarien kann deren Funktion durch chirurgische Verlagerung nach kraniolateral, d. h. aus dem Strahlenfeld, geschützt werden. Wenn möglich, sollte die Ovariopexie minimal invasiv als Laparoskopie durchgeführt werden oder im Rahmen einer offenen Tumoroperation. Aufgrund der Streustrahlung kann die Kombination dieser Maßnahme mit der Entnahme von Ovargewebe zur Kryokonservierung erwogen werden.
Bei kombinierter Radiochemotherapie ist das zusätzliche Schädigungsrisiko durch die geplanten Zytostatika bei der Entscheidung zu berücksichtigen.
8.1.1.2 Kryokonservierung von Oozyten
Nach hormoneller Stimulation werden Eizellen mittels vaginaler Follikelpunktion gewonnen. Bei Patientinnen mit festem Partner besteht die Möglichkeit der intrazytoplasmatischen Spermieninjektion (ICSI) mit Kryokonservierung befruchteter Eizellen, allerdings können die befruchteten Eizellen später nur mit dem Einverständnis beider Partner zurückgegeben werden. Eine Alternative ist die Kryokonservierung von nicht fertilisierten Oozyten. Hierbei sind die Schwangerschaftsraten im Vergleich zu kryokonservierten befruchteten Eizellen reduziert. Der Zeitbedarf für die hormonelle Stimulation beträgt etwa 14 Tage, die Stimulation kann mittels neuer Stimulationsprotokolle zyklusunabhängig begonnen werden [21, 34]. Das Auftreten eines ovariellen Überstimulationssyndroms (= OHSS) mit einer notwendigen Verschiebung des Beginns der Chemotherapie ist selten.
8.1.1.3 Kryokonservierung von Ovarialgewebe
Die Kryokonservierung von laparoskopisch entnommenem Ovarialgewebe ist ein neuer, experimenteller Ansatz. Aufgrund der mit dem Alter abnehmenden Follikeldichte im Ovar wird diese fertilitätsprotektive Technik nur bei Frauen bis zu einem Alter von 35 Jahren empfohlen. Die Maßnahme ist partnerunabhängig und würde bei einem späteren erfolgreichen Angehen des Transplantates auch die endokrinologische Situation der Patientin verbessern. Der Zeitbedarf beträgt 2 Tage. Bisher liegen nur wenige Daten über die erfolgreiche Retransplantation des Gewebes vor. Weltweit sind Berichte von 9 Schwangerschaften publiziert worden.
8.1.1.4 GnRH Analoga
Die Rationale für den Einsatz von GnRH Analoga zur Verzögerung oder Verhinderung eines vorzeitigen Versagens der Ovarialfunktion beruht auf Tierversuchen. Die meisten Studien bei Menschen sind retrospektiv. Übereinstimmend wurde kein protektiver Effekt bei Strahlentherapie beobachtet. Prospektive Studien bei Chemotherapiepatientinnen wurden an kleinen Kollektiven und / oder mit kurzer Nachbeobachtungszeit durchgeführt und zeigen eine inkonsistente Datenlage [4, 6, 7, 9, 17, 30]. Nebenwirkungen der GnRH Analoga können klimakterische Beschwerden sein und bei einer Behandlung über die Dauer von 6 Monaten zu einer Reduktion der Knochenmasse führen.
Der Einsatz von GnRH Analoga zur Ovarialprotektion unter Chemotherapie ist keine Standardtherapie. Bei Strahlentherapie sind GnRH Analoga nicht protektiv wirksam.
8.1.2 Männer
Transiente Infertilität ist eine häufige Nebenwirkung onkologischer Therapie bei Männern. Sie kann bis zu 2 Jahre nach Therapieende persistieren, in Abhängigkeit von der Art der Behandlung auch irreversibel sein. Messparameter im Ejakulat sind Spermienkonzentration, - motilität und - morphologie.
8.1.2.1 Kryokonservierung von Spermien
Die Kryokonservierung von durch Masturbation gewonnenen Spermien ist eine sichere und etablierte Methode [22, 23]. Sie wird vor Beginn der Chemo- oder Strahlentherapie durchgeführt. Eine optimale Ausbeute wird nach sexueller Abstinenz über mindestens 48 Stunden erzielt. Erfolgreiche Befruchtungen sind nach Kryokonservierung der Spermien über weit mehr als 10 Jahre möglich.
Falls Masturbation oder Ejakulation nicht möglich sind, besteht die Möglichkeit der Spermiengewinnung durch eine Hodenbiopsie.
8.2 Zweitneoplasien
Patienten mit der Erstdiagnose einer Krebserkrankung im Alter zwischen 18 - 39 Jahren haben insgesamt ein 2 - 3 fach erhöhtes Risiko für eine Zweitneoplasie [11]. Das Muster der Zweitneoplasien ist vor allem abhängig von der Art der Ersterkrankung. Dominierende Ursache sind gemeinsame prädisponierende Faktoren, z. B. genetisch oder toxisch: Das relativ höchste Risiko für Patienten mit Mammakarzinom oder Hodentumoren ist eine kontralaterale Zweitneoplasie.
Bestandteile der onkologischen Therapie wie Bestrahlung oder bestimmte Substanzen der Chemotherapie haben selbst mutagenes Potential. Das höchste Risiko besteht bei kombinierter oder sequentieller Radiochemotherapie und / oder Hochdosistherapien. Distinkte Zweitneoplasien sind das Mammakarzinom bei Patientinnen mit Z. n. Mediastinalbestrahlung vor dem 30. Lebensjahr [11] oder das Schilddrüsenkarzinom bei Z. n. Zervikalbestrahlung vor dem 20. Lebensjahr [11]. Der relative Anteil iatrogener Zweitneoplasien ist gering [11].
Dem erhöhten Risiko für bestimmte Zweitneoplasien stehen signifikant erniedrigte Risiken für andere Neoplasien gegenüber [11]. Es ist nicht geklärt, ob dies auf prädisponierende Faktoren oder Folgen eines gesünderen Lebensstils nach der Erstdiagnose zurückzuführen ist.
Allgemein gültige Konzepte im Sinne von Nachsorge = Vorsorge gibt es bisher für Heranwachsende und junge Erwachsene nicht. Individuelle Konzepte für Prävention und Früherkennung von Zweitneoplasien orientieren sich an der jeweiligen Erstdiagnose.
8.3 Weitere Spätfolgen
Vor allem die medikamentöse Therapie und die Bestrahlung, aber auch Operationen, können langfristig endokrine (z. B. Hypothyreose), kardiovaskuläre (z. B. Kardiomyopathie, koronare Herzkrankheit), pulmonale (z. B. Lungenfibrose) und andere somatische Funktionen beeinträchtigen. Diese Folgen sind nicht spezifisch für Heranwachsende und junge Erwachsene, führen aber gerade bei diesen Patienten zu erheblicher Morbidität und Beeinträchtigung der Lebensqualität. Aufgrund fehlender kontrollierter Studien muss die Beratung, Diagnostik und Therapie auf individueller Basis erfolgen.
9 Rehabilitation
Die onkologische Therapie kann zu Folgestörungen unterschiedlichen Schweregrades führen. Wichtigste Ziele rehabilitativer Maßnahmen sind die Überwindung körperlicher Einschränkungen, die Förderung der Krankheitsverarbeitung, Reintegration in das gesellschaftliche Leben und berufliche Reintegration [26].
Die Patienten sollen über die Möglichkeiten ambulanter und stationärer Rehabilitationsmaßnahmen sowie weiterer Ansprüche, die sich aus dem Sozialrecht ergeben, frühzeitig informiert werden. Hinsichtlich der Rehabilitationsklinik sollen die Wünsche der Patienten berücksichtigt werden (§9 SGB IX). Für Heranwachsende und junge Erwachsenen wird die Rehabilitation in Einrichtungen empfohlen, die auf die besonderen Bedürfnisse dieser Patientengruppe spezialisiert sind.
10 Literatur
- Anders CK, Fan C, Parker et al.: Breast carcinomas arising at a young age: unique biology or a surrogate for aggressive intrinsic subtypes. J Clin Oncol 29: e18-e20, 2011. DOI: 10.1200/JCO.2010.28.9199
- Arndt V, Merx H, Stürmer T, Stegmaier C et al.: Age-specific detriments to quality of life among breast cancer patients one year after diagnosis. Eur J Cancer 40:673-80, 2003. DOI: 10.1016/j.ejca.2003.12.007
- Arndt, V, Merx H, Stegmaier C et al.: Quality of life in patients with colorectal cancer 1 year after diagnosis compared with the general population: a population-based study. J Clin Oncol 22:4829-4836, 2004. DOI: 10.1200/JCO.2004.02.018
- Badawy A, Elnashar A, El-Ashry M, Shahat M. Gonadotropin-releasing hormone agonists for prevention of chemotherapy-induced ovarian damage: prospective randomized study. Fertil Steril 91: 694-697, 2009. DOI: 10.1016/j.fertnstert.2007.12.044
- Behringer K, Breuer K, Reineke T et al. for the German Hodgkin’s Lymphoma Study Group: Secondary amenorrhea after Hodgkin’s lymphoma is influenced by age at treatment, stage of disease, chemotherapy regimen, and the use of oral contraceptives during therapy: a report from the German Hodgkin’s Lymphoma Study Group. J Clin Oncol 23: 7555-7564, 2005. DOI: 10.1200/JCO.2005.08.138
- Behringer K, Wildt L, Müller H et al. on behalf of the German Hodgkin Study Group: No protection of the ovarian follicle pool with the use of GnRH-analogues or oral contraceptives in young women treated with escalated BEACOPP for advanced-stage Hodgkin lymphoma. Final results of a phase II trial from the German Hodgkin Study Group. Annals of Oncology 21: 2052-2060, 2010. DOI: 10.1093/annonc/mdq066
- Ben-Aharon I, Gafter-Gvili A, Leibovici L et al.: Pharmacological intenventions for fertility preservation during chemotherapy: a systematic review and meta-analysis. Breast Cancer Res Treat 122:803-811, 2010. DOI: 10.1007/s10549-010-0996-7
- Bleyer A. The adolescent and young adult gap in cancer care and outcome. Curr Probl Pediatr Adolesc Health Care 35:182-217, 2005. PMID: 15841070
- Blumenfeld Z, von Wolff M: GnRH-analogues and oral contraceptives for fertility preservation in women during chemotherapy. Human Reproduction Update 14:543-552, 2008. DOI: 10.1093/humupd/dmn022
- Butow P, Palmer S, Pai A, Goodenough B, Luckett T, King M. Review of adherence-related issues in adolescents and young adults with cancer. J Clin Oncol 28:4800-4809, 2010. DOI: 10.1200/JCO.2009.22.2802
- Curtis RE, Freedman DM, Ron E et al: New malignancies among cancer survivors. SEER Cancer Registries, 1973 - 2000. National Cancer Institute, NIH, Publ. No. 05-5302, Bethesda, MD, 2006.
- De Bruin ML, Huisbrink J, Hauptmann et al.: Treatment-related risk factors for premature menopause follwoing Hodgkin lymphoma. Blood 111:101-108, 2008. DOI: 10.1182/blood-2007-05-090225
- Gesellschaft der epidemiologischen Krebsregister in Deutschland / Robert - Koch Institut: Krebs in Deutschland 2005 - 2006, Häufigkeiten und Trends: Niere, 6. Auflage 2010; 80 - 83. http://www.ekr.med.uni-erlangen.de/GEKID/
- Giuliano AP, Palefsky JM, Goldstone S et al.: Efficacy of quadrivalent HPV vaccine against HPV infection and disease in males. N Engl J Med 364:401-411, 2011. PMID: 21288094
- Hayes-Lattin B, Mathews-Bradshaw B, Siegel: Adolescent and young adult oncology training for health professionals: a position statement. J Clin Oncol 28:4848-4861, 2010. DOI: 10.1200/JCO.2010.30.5508
- Hilgendorf I, Freund M, Kropp P et al.: Onkologische Erkrankungen bei Jugendlichen und jungen Erwachsenen - Zahlen aus dem Klinischen Krebsregister Rostock als Arbeitsgrundlage für eine interdisziplimäre Herausforderung. Tumordiagnostik und Therapie 32:85-92, 2011.
- Ismail-Khan R, Minton S, Cox C et al.: Preservation of ovarian functionin young women treated with neoadjuvant chemotherapy for breast cancer: a randomized trial using the GnRH agonist (triptorelin) during chemotherapy. J Clin Oncol 26 (May 20 suppl. abstract 524), 2008
- Jaglowski SM, Linden E, Termuhlen et al.: Lymphoma in adolescents and young adults. Semin Oncol 36:381-418, 2009. PMID: 19835736
- Kato PM, Cole SW, Bradlyn AS et al.: A video game improves behavorial outcomes in adolescents and young adults with cancer: a randomized trial. Pediatrics 122:e305-3217, 2008. DOI: 10.1542/peds.2007-3134
- Lawrenz B, von Wolff M: FertiPROTEKT-Netzwerk für fertilitätsprotektive Maßnahmen bei Chemo- und Strahlentherapie. Journal für Reproduktionsmedizin und Endokrinologie 7:147-150, 2010.
- Lawrenz B, Jauckus J, Kupka M, et al.: Efficacy and safety of ovarian stimulation before chemotherapy in 205 cases. Fertil Steril 94:2871-2873, 2010. DOI: 10.1016/j.fertnstert.2010.06.054
- Lee SJ, Schover LR, Partridge AH et al.: American Society of Clinical Oncology recommendations on fertility preservation in cancer patients. J Clin Oncol 24:2917-2931 2006. DOI: 10.1200/JCO.2006.06.5888
- Levine, J, Canada A, Stern CJ: Fertility preservation in adolescents and young adults with cancer. J Clin Oncol 28:4831-4841,2010. DOI: 10.1200/JCO.2009.22.8312
- Merckaert I, Libert Y, Messin S et al.: Cancer patients' desire for psychological support: prevalence and implications for screening patients' psychological needs. Psychooncology. 19:141-149, 2010. DOI:10.1002/pon.1568
- Morgan S, Davies S, Palmer S et al.: Sex, drugs and rock’n roll: caring for adolescents and young adults with cancer. J Clin Oncol 28:4825-4830, 2010. DOI: 10.1200/JCO.2009.22.5474
- Mumm A, Willenbacher W, Weis J et al.: Rehabilitation nach Hochdosischemotherapie und allogener KMT. In: Schmoll et al.: Internistische Onkologie, 5. Auflage, 2011 (geplant)
- Pearce S. Policy and practice in teenage and young adult cancer care in England: looking to the future. Eur J Oncol Nurs. 2009; 13: 149-153, 2009. PMID: 19577960
- Sawyer SM, Drew S, Yea MS et al.: Adolescents with a chronic condition: challenges living, challenges treating. Lancet 369:1481-1489, 2007. DOI: 10.1016/S0140-6736(07)60370-5
- Soliman H, Agresta SV: Current issues in adolescent and young adult cancer survivorship. Cancer Control 15: 55-62, 2008. PMID: 18094661
- Sverrisdottir A, Nystedt M, Johansson H, Fornander T. Adjuvant goserelin and ovarian preservation in chemotherapy treated patients with early breast cancer: results from a randomized trial. Breast Cancer Res Treat 117: 561-567; 2009. DOI: 10.1007/s10549-009-0313-5
- Tricot S, Decanter C, Salleron J et al.: Evaluation of chemotherapy-induced ovarian failure by sequential Anti-Müllerian Hormone Dosage. Blood 116 (ASH Abstract 3813), 2010.
- von Wolff M, Montag M, Dittrich R, Denschlag D, Nawroth F, Lawrenz B. Fertilitätsprotektion bei Frauen. Geburtsh Frauenheilk 70:R85-R100, 2010.
- von Wolff M, Montag M, Dittrich R, Denschlag D, Nawroth F, Lawrenz B. Fertility preservation in women-a practical guide to preservation techniques and therapeutic strategies in breast cancer, Hodgkin's lymphoma and borderline ovarian tumours by the fertility preservation network. FertiPROTEKT. Arch Gynecol Obstet, E-pub ahead of print, 2011. DOI: 10.1007/s00404-011-1874-1
- von Wolff M, Thaler C, Frambach T, Zeeb C, Lawrenz B, Popovici RM, Strowitzki T. Ovarian stimulation to cryopreserve fertilized oocytes in cancer patients can be started in the luteal phase. Fertil Steril 92:1360-1365, 2009. DOI: 10.1016/j.fertnstert.2008.08.011
- Vos MS, de Haes JC: Denial in cancer patients, an explorative review. Psychooncology 16:12-25, 2007. DOI:10.1002/pon.1051
- Wood WA, Lee SJ: Malignant hematologic diseases in adolescents and young adults. Blood, Epub March 11, 2011. DOI: 10.1182/blood-2010-12-283093
- Zebrack B, Mathews-Bradshaw B, Siegel S: Quality cancer care for adolescents and young adults: a position statement. J Clin Oncol 28:4862-4867, 2010. DOI: 10.1200/JCO.2010.30.5417
11 Links
Netzwerk für fertilitätsprotektive Maßnahmen
Rehakliniken mit einem besonderen Schwerpunkt für Heranwachsende und junge Erwachsene
Rehabilitationsklinik Katharinenhöhe
Oberer Katzensteig 11
78141 Schönwald/Schwarzwald
Tel: 07723 / 6503-0
www.katharinenhoehe.de
Klinik Bad Oexen
Oexen 27
32549 Bad Oeynhausen
Tel: 05731 / 537-0
www.jer-reha.de
Luise von Marillac Klinik
Elly-Heuss-Knapp.Weg 7
73337 Bad Überkingen
Tel.: 07331 / 4422-0
www.marillac-klinik.de
12 Anschriften der Verfasser
13 Erklärung zu möglichen Interessenkonflikten
nach den Regeln der DGHO Deutsche Gesellschaft für Hämatologie und Onkologie und den Empfehlungen der AWMF (Version vom 23. April 2010) und internationalen Empfehlungen.
Download
Reference:
Quellenangabe:
Onkopedia-Leitlinien werden kontinuierlich an den Stand des Wissens angepasst. Die jeweils gültige Version, AGB und Nutzungsbedingungen finden Sie unter www.onkopedia.com.
Für die kommerzielle Nutzung wenden Sie sich bitte an onkopedia@dgho.de.
Onkopedia guidelines are continuously adapted to the state of knowledge. The currently valid version, terms of use and general terms and conditions can be found at onkopedia-guidelines.info.
For commercial use, please contact onkopedia@dgho.de.




